สารละลายบัฟเฟอร์
สารละลายบัฟเฟอร์ (Buffer solution)
สารละลายบัฟเฟอร์ หมายถึง สารละลายที่มีความสามารถในการควบคุมระดับ pH เอาไว้ได้ เมื่อเติมสารละลายกรดหรือเบสจำนวนที่ไม่มากเกินไป เมื่อเปรียบเทียบกับน้ำบริสุทธิ์ที่เติมกรดหรือเบสจำนวนเท่ากัน สารละลายที่มีสมบัติเป็นสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น สารละลายบัฟเฟอร์เกิดจากการผสมระหว่างสารละลายกรดอ่อนกับเกลือของกรดอ่อนนั้น หรือสารละลายเบสอ่อนกับเกลือของเบสอ่อนนั้น แม้ว่าสารละลายบัฟเฟอร์จะควบคุมระดับ pH เอาไว้ได้ดีกว่าน้ำกลั่น แต่ถ้าเติมกรดหรือเบสมากเกินไป สารละลายบัฟเฟอร์ก็จะไม่สามารถควบคุมระดับ pH เอาไว้ได้ตลอด
ในที่สุดจะเสียสมบัติในการเป็นสารละลายบัฟเฟอร์ไป เราเรียกความสามารถในการควบคุมระดับ pH ของสารละลายบัฟเฟอร์ว่า buffer capacity
ในที่สุดจะเสียสมบัติในการเป็นสารละลายบัฟเฟอร์ไป เราเรียกความสามารถในการควบคุมระดับ pH ของสารละลายบัฟเฟอร์ว่า buffer capacity
สารละลายบัฟเฟอร์มี 2 ประเภท
1) บัฟเฟอร์กรด (Acid buffer solution) เกิดจากสารละลายของกรดอ่อนผสมกับสารละลายเกลือของกรดอ่อนชนิดนั้น สารละลายบัฟเฟอร์ประเภทนี้มี pH < 7 เช่น
CH3COOH (กรดอ่อน) + CH3COONa (เกลือของกรดอ่อน)
HCN (กรดอ่อน) + KCN (เกลือของกรดอ่อน)
H2S(กรดอ่อน) + Na2S (เกลือของกรดอ่อน)
H2CO3(กรดอ่อน) + NaHCO3 (เกลือของกรดอ่อน)
CH3COOH (กรดอ่อน) + CH3COONa (เกลือของกรดอ่อน)
HCN (กรดอ่อน) + KCN (เกลือของกรดอ่อน)
H2S(กรดอ่อน) + Na2S (เกลือของกรดอ่อน)
H2CO3(กรดอ่อน) + NaHCO3 (เกลือของกรดอ่อน)
2) บัฟเฟอร์เบส (Basic buffer solution) เกิดจากสารละลายของเบสอ่อนผสมกับสารละลายเกลือของเบสอ่อนนั้น สารละลายบัฟเฟอร์แบบนี้ มี pH > 7 เช่น
NH3 (เบสอ่อน) + NH4Cl (เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4NO3 (เกลือของเบสอ่อน)
Fe(OH)2 (เบสอ่อน) + FeCl2 (เกลือของเบสอ่อน)
Fe(OH)3 (เบสอ่อน) + FeCl3 (เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4Cl (เกลือของเบสอ่อน)
NH3 (เบสอ่อน) + NH4NO3 (เกลือของเบสอ่อน)
Fe(OH)2 (เบสอ่อน) + FeCl2 (เกลือของเบสอ่อน)
Fe(OH)3 (เบสอ่อน) + FeCl3 (เกลือของเบสอ่อน)
วิธีเตรียมสารละลายบัฟเฟอร์
1. เตรียมโดยตรงจากการผสมสารละลายของกรดอ่อนกับสารละลายเกลือของกรดอ่อนนั้น หรือผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนนั้น ดังรูป
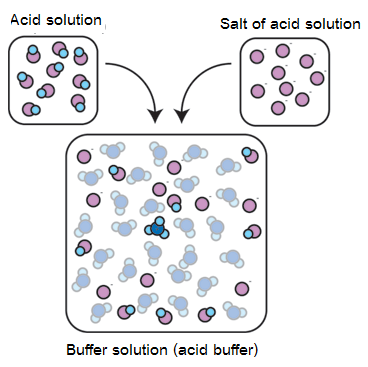

2. เตรียมจากปฏิกิริยาระหว่างกรดกับเบส
2.1 บัฟเฟอร์กรด เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
2.1 บัฟเฟอร์กรด เตรียมโดยใช้สารละลสยของกรดอ่อนที่มากเกินพอ ทำปฏิกิริยากับเบส (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่ากรดอ่อนจนถูกใช้หมด) เช่น
HF(aq) + NaOH(aq) ↔ NaF(aq) + H2O(l)
(กรดอ่อนมากเกินพอ) (หมด) (เกลือของกรดอ่อนที่เกิดขึ้น)
(มีเหลือ)
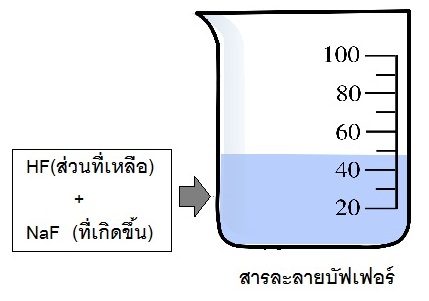
ถ้าใช้ HF มากเกินพอจะมี HF เหลืออยู่ เมื่อเกิดปฏิกิริยาจนสมบูรณ์แล้ว NaOH จะหมดไป ในระบบจะเป็นสารละลายผสมระหว่างHF ส่วนที่เหลือ กับ NaF ที่เกิดขึ้น (กรดอ่อนมากเกินพอ) (หมด) (เกลือของกรดอ่อนที่เกิดขึ้น)
(มีเหลือ)
จึงเป็นบัฟเฟอร์กรด (กรดอ่อน+เกลือของกรดอ่อนนั้น) ดังรูป
2.2 บัฟเฟอร์เบส เตรียมโดยใช้สารละลายเบสอ่อนที่มากเกินพอ ทำปฎิกิริยากับสารละลายกรดกรด (แก่หรืออ่อนก็ได้ แต่ต้องมีจำนวนน้อยกว่าเบสอ่อนจนถูกใช้หมด) เช่น
HCl(aq) + NH4OH(aq) → NH4Cl(aq) + H2O(l)
(หมด) (มากเกินพอ) (เกิดขึ้น)
มีเหลือ
(หมด) (มากเกินพอ) (เกิดขึ้น)
มีเหลือ
เมื่อเกิดปฏิกิริยาสมบูรณ์แล้ว HCl จะหมดไปแต่ NH4OH ยังมีเหลือ ฉะนั้นในระบบจะเป็นสารละลายผสมระหว่าง NH4OH สว่นที่เหลือ กับ NH4Cl ที่เกิดขึ้น จึงเป็นสารละลายบัฟเฟอร์เบส (เบสอ่อน + เกลือของเบสอ่อนนั้น)
การควบคุมค่า pH ของสารละลายบัฟเฟอร์
ส่วนประกอบของสารละลายบัฟเฟอร์ จะแตกต่างจากสารละลายของกรดอ่อนหรือเบสอ่อน คือ ในสารละลายกรดอ่อนจะมีอนุภาคของกรดอ่อนละลายอยู่มาก แต่อนุภาคของคู่เบสมีน้อย เช่น
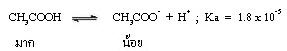
แต่เมื่อผสมสารละลายเกลือของ CH3COOH เช่น CH3COONa ซึ่งเป็นสารไอออนิกที่ละลายน้ำได้ดี แตกตัวเป็นไอออนได้ทั้งหมด จึงมี CH3COO- อยู่เป็นจำนวนมาก ดังนี้
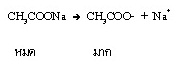
เมื่อนำมาผสมกันจะมีสมบัติเป็นสารละลายบัฟเฟอร์ ให้สังเกตว่าในสารละลายจะมีกรดอ่อนและคูเบสของกรดอ่อนเป็นจำนวนมากทั้งคู่ ดังสมการ
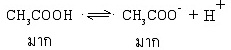
การที่ในสารละลายมี กรดอ่อนและคู่เบสของกรดอ่อนนั้นอยู่เป็นจำนวนมาก ทำให้สามารถควบคุมระดับความเป็นกรด-เบสของสารละลายเอาไว้ได้จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ เพราะ ...
- เมื่อเติมกรด (H+) กรดหรือ H+ ที่เติมลงไปก็จะรวมตัวกับ CH3COO- เกิดปฏิกิริยาย้อนกลับเปลี่ยนให้อยู่ในรูป CH3COOH ได้เกือบทั้งหมด ทำให้ความเข้มข้น H+ เพิ่มขึ้นน้อยกว่า
จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
(คลิ้ก ฃมการควบคุม pH ของสารละลายบัฟเฟอร์กรด)
จำนวนที่เติมลงไปจริง pH จึงแปลี่ยนแปลงน้อยกว่าปริมาณของ H+ ที่เติมลงไปจริง
(คลิ้ก ฃมการควบคุม pH ของสารละลายบัฟเฟอร์กรด)
- เมื่อเติมเบส (OH-) เบสหรือ OH- ที่เติมลงไปก็จะรวมตัวกับ H+ เปลี่ยนให้มาอยู่ในรูป H2O ทำให้ H+ ลดลงในตอนแรก แต่ในเวลาเดียวกัน CH3COOH ซึ่งมีอยู่มาก
(สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้ H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH-
ที่เติมลงไปจริง
สำหรับสารละลายบัฟเฟอร์เบสก็จะมีลักษณะเช่นเดียวกัน คือเบสอ่อนแตกตัวได้น้อย เช่น การละลายของ NH4OH ดังสมการ ; (สังเกตทางซ้ายของสมการ)ก็จะเกิดการแตกตัวให้ H+ มาทดแทนได้เกือบทั้งหมด ทำให้ปริมาณของ H+ จึงลดลงน้อยกว่าปริมาณของ OH- ที่เติม pH จึงเปลี่ยนแปลงน้อยกว่าปริมาณของ OH-
ที่เติมลงไปจริง
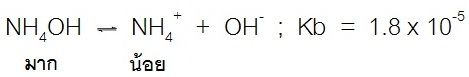
แต่สำหรับเกลือของเบสชนิดนี้ เช่น NH4Cl จะละลายน้ำได้ดี ดังสมการ
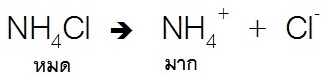
เมื่อผสมสารละลายของเบสอ่อนกับสารละลายเกลือของเบสอ่อนเข้าด้วยกัน ในสารละลายที่ได้จากการผสมก็จะมีมากทั้งตัวของเบสอ่อนลัคู่กรดของมัน จึงมีสมบัติเป็นสารละลายบัฟเฟอร์ ดังสมการ
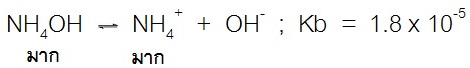
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์เบส)
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์กรดเมื่อเติมเบสหรือเบส)
การหา pH ของสารละลายบัฟเฟอร์ 1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ
(คลิ้ก ชมการควบคุม pH ของสารละลายบัฟเฟอร์กรดเมื่อเติมเบสหรือเบส)
การหา pH ของสารละลายบัฟเฟอร์ 1. สารละลายบัฟเฟอร์กรดหา pH จากสมการ
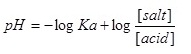
ตัวอย่าง สารละลายบัฟเฟอร์ประกอบด้วย สารละลายกรดอะซิติกกับสารละลายโซเดียมอะซิเตต ซึ่งเข้มข้น 0.1 โมล/ลิตรเท่ากันและมีปริมาตร 100 cm3 เท่ากันด้วย ถ้า Ka ของกรดอะซิติกเท่ากับ
1.8 x 10-5 จงหา pH ของสารละลายบัปเฟอร์นี้
วิธีทำ
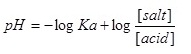
= -log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 + log 1
= 5 – log 1.8 + log 1
= 5 – 0.26
= 4.24
2. สารละลายบัฟเฟอร์เบส หา pH ได้ดังนี้
จากนั้นจึงหา pH จากสมการ
pH = 14 – pOH
ตัวอย่าง สารละลายบัฟเฟอร์ที่เกิดจากผสมสารละลายเบสอ่อน NH4OH และเกลือ NH4Cl ซึ่งมีความเข้มข้น 0.1 โมล/ลิตรเท่ากัน และมีปริมาตร 100cm3 เท่ากันด้วย ถ้า Kb ของ NH4OH
เท่ากับ 1.8 x 10-5 สารละลายบัฟเฟอร์นี้มี pH เท่าไร
เท่ากับ 1.8 x 10-5 สารละลายบัฟเฟอร์นี้มี pH เท่าไร
= - log 1.8 x 10-5 + log (0.1 / 0.1 )
= 5 – log 1.8 +log 1
= 5 – 0.26
= 4.74
pH = 14 – pOH
= 14 – 4.74
= 9.26
การเตรียมสารละลายบัฟเฟอร์ สารละลายบัฟเฟอร์เป็นสารละลายที่มีราคาแพง ใช้ในงานเฉพาะแต่ละด้าน เช่น ในการปรับเพื่อตั้งค่าให้ถูกต้องของเครื่องมือวิทยาศาสตร์บางชนิด สารละลายบัฟเฟอร์สำหรับการตั้งค่า
pH meter ราคา 690 บาท / 500 ml
pH meter ราคา 690 บาท / 500 ml

สารละลายบัฟเฟอร์จะมีค่า pH ต่าง ๆ กัน การเตรียมสารละลายบัฟเฟอร์ให้มี pH ตามที่ต้องการให้ดูจากค่า pKa ของกรดอ่อน เช่น ถ้ากรดอ่น HA มีค่า Ka = 1.0 x 10-6 ค่า pKa = 6 กรดอ่อนชนิดนี้จะเหมาะสำหรับเตรียมสารละลายบัฟเฟอร์ที่มี pH=6
จากสมการจะเห็นว่า [salt] และ [acid] จะมีผลต่อ pH ของสารละลายบัฟเฟอร์ แต่พบว่าถ้า [salt] = [acid] สารละลายบัฟเฟอร์จะมีคุณภาพดีที่สุด
ถ้า [salt] = [acid] ; 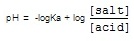
= -log 1.0 x 10-6 + log 1
= 6
= -log 1.0 x 10-6 + log 1
= 6
ถ้า [salt] = 2เท่าของ [acid] ; 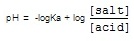
= -log 1.0 x 10-6 + log 2
= 6.3
= -log 1.0 x 10-6 + log 2
= 6.3
ถ้า [acid] = 2เท่าของ[salt]; 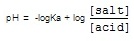
= -log 1.0 x 10-6 + log 0.5
= 6 - 0.3
= -log 1.0 x 10-6 + log 0.5
= 6 - 0.3
= 5.7
ไม่มีความคิดเห็น:
แสดงความคิดเห็น